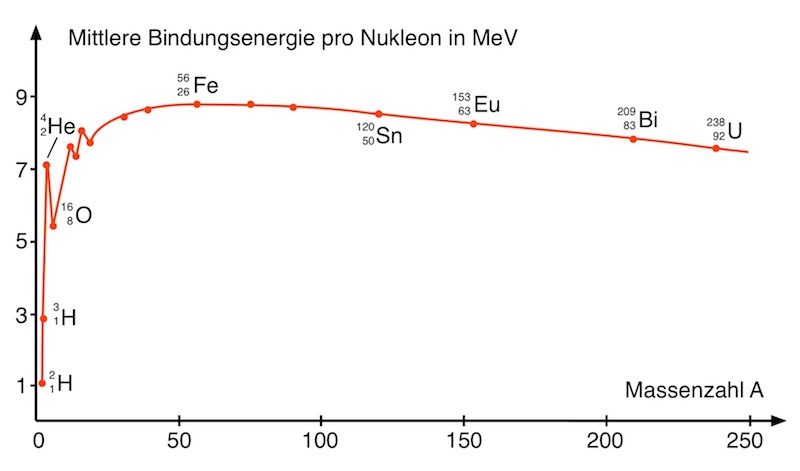
Warum halten Atomkerne zusammen?
Atomkerne bestehen aus Protonen und Neutronen, die einen extrem geringen Abstand voneinander haben. Doch warum halten Atomkerne überhaupt zusammen? Ohne weitere Kraft müssten sich die Protonen aufgrund der abstoßenden Coulombkraft mit hoher Geschwindigkeit voneinander entfernen.
Der mehr oder weniger stabile Zusammenhalt der Atomkerne legt nahe, dass es eine zwischen den Nukleonen wirkende anziehende Kraft geben muss, die stärker ist als die zwischen Protonen wirkende abstoßende Coulombkraft.
Der Massendefekt
Jedes Atom besteht aus einer bestimmten Anzahl von Protonen, Neutronen und Elektronen. Aus Kernladungszahl und Massenzahl sollte sich die Masse eines Atoms bzw. eines Atomkernes bei bekannten Massen der Bestandteile genau berechnen lassen. Wir wollen dies am Beispiel des Heliumatoms 4He überprüfen:
Die Masse von Atomen lässt sich experimentell sehr genau mit Hilfe von Massenspektrometern bestimmen.
Die Masse eines Heliumatoms (4He) beträgt ![]() .
.
Das Heliumatom besteht aus je 2 Protonen, 2 Neutronen und 2 Elektronen.
Die genauen Massen der Bausteine eines Atoms betragen in der Einheit u:
![]()
![]()
![]()
Berechnet man mit Hilfe dieser Werte die Masse der Bestandteile des Heliumatoms, so erhält man
![]()
Vergleicht man nun diese Masse mit der Atommasse des Heliumatoms (s.o.), so stellt man fest:
Die Masse des Atoms ist geringer als die Summe der Massen der Bestandteile.
Die Differenz der beiden Massen beträgt ![]() .
.
Die gleiche Differenz ergibt sich, wenn man die Masse des Atomkerns mit der Summe der Massen der Nukleonen vergleicht.
Dieser Umstand ist nicht auf das Heliumatom beschränkt, sondern gilt für jedes Atom. Die Massendifferenz wird als Massendefekt bezeichnet.