Das Bohrsche Atommodell
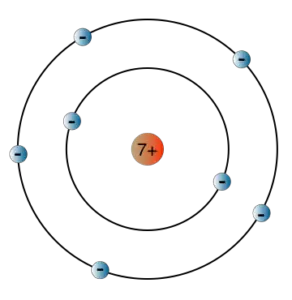
Wir wollen nun mit dem Bohrschen Atommodell, welches wir bereits im Abschnitt zur quantenhaften Emission und Absorption kennengelernt haben, einige Berechnungen durchführen.
Auch wenn das Bohrsche Atommodell deutliche Schwächen hat und inzwischen vom quantenmechanischen Atommodell abgelöst wurde, so lassen sich mit ihm – zumindest für das Wasserstoffatom – viele Berechnungen durchführen, die zu richtigen Ergebnissen führen.
Mit Bohrs Postulaten lassen sich die empirischen Formeln von Johann Balmer und Johannes Rydberg logisch herleiten, die über 20 Jahre lang unverstanden blieben. Die empirische Größe der Rydberg-Konstante konnte Bohr auf Naturkonstanten zurückführen.
Trotz aller Schwächen hat sich das Bohrsche Atommodell mit um den Atomkern kreisenden Elektronen in den Köpfen vieler Menschen festgesetzt.
Die Berechnungen, die sich damit durchführen lassen, tragen außerdem noch heute zum Verständnis des quantenmechanischen Atommodells bei.
Die Bohrschen Postulate

Niels Bohr
Auf der Bahn des Elektrons um den Atomkern sind nur ganz bestimmte Bahnen erlaubt, wobei jede Bahn einer Energiestufe entspricht. Niels Bohr konnte allerdings selbst nicht erklären, warum die Elektronen auf ihrer Bahn um den Kern keine Energie abgeben und dadurch in den Kern stürzen, wie es nach den Gesetzen der Elektrodynamik der Fall sein müsste.
Er umging die Probleme seines Atommodells mit verschiedenen Annahmen, die als Bohr’sche Postulate bezeichnet werden. Diese wollen wir hier noch einmal nennen:
1. Im Atom existieren stabile Bahnen, auf denen die Elektronen kreisen, ohne Energie abzugeben.
Für den energetischen Aspekt eines Elektronenübergangs von einer Bahn zu einer anderen soll gelten:
2. Jede erlaubte Elektronenbahn entspricht einer bestimmten Energie E der Elektronen. Wechselt ein Elektron die Bahn, so ist die Energie des emittierten bzw. absorbierten Photons gleich der Energiedifferenz dieser Bahnen.
Dabei gilt: ΔE = h · f
3. Bohr’sche Quantenbedingung
Für den Zusammenhang zwischen dem Bahnumfang Un, der Elektronenmasse me, der Elektronengeschwindigkeit vn sowie der planckschen Konstante h gilt:
Die Bohr’sche Quantenbedingung lautet: Un · me · vn = n · h
wobei die Zahlen n = 1, 2, 3, … den Energiestufen entspricht. Sie entsprechen den Hauptquantenzahlen.
Berechnung der diskreten Energiezustände im Wasserstoffatom
Wir wollen mit Hilfe der Bohrschen Annahmen die Energiestufen und damit die möglichen Energiedifferenzen, aus denen sich die möglichen Spektrallinien ergeben, berechnen:
Nach dem 2. Bohrschen Postulat gilt für die Energie eines emittierten oder absorbierten Photons
![]() ,
,
wobei ![]() die Energie des Elektrons auf der n-ten Bahn ist.
die Energie des Elektrons auf der n-ten Bahn ist.
Die Gesamtenergie eines Elektrons setzt sich zusammen aus potentieller und kinetischer Energie (potentielle Energie aufgrund der Coulomb-Kraft und des Abstandes vom Kern).
Für die Energie eines Elektrons auf der n-ten Bahn gilt also
![]()
Wir wollen nun jeweils die kinetische und die potentielle Energie berechnen.