Was versteht man unter radioaktivem Zerfall?
Da bei der Entstehung radioaktiver Strahlung Atomkerne in neue Kerne umgewandelt werden, die ursprünglichen Kerne also „zerfallen“, spricht man von radioaktivem Zerfall.
Je nach Strahlungsart unterscheidet man zwischen den verschiedenen Zerfallsarten α-Zerfall, β-Zerfall und γ-Zerfall.
Um zu verstehen, was bei den jeweiligen Zerfällen mit dem Atomkern passiert, benötigen wir ein wenig Hintergrundwissen über den Aufbau von Atomkernen sowie einige Begriffe, die im folgenden Abschnitt erklärt werden:
Nuklide und Isotope – Kennzeichnung durch Massenzahl und Kernladungszahl
Wie im ersten Abschnitt beschrieben, bestehen Atomkerne aus Protonen und (bis auf das Wasserstoffatom) Neutronen.
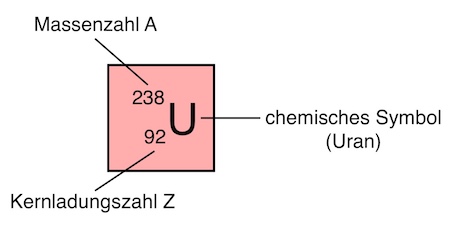
Die Anzahl der Protonen und Neutronen werden im Periodensystem durch zwei Zahlen gekennzeichnet:
Die Kernladungszahl bzw. Ordnungszahl Z (= Anzahl der Protonen)
Die Massenzahl A (Anzahl der Protonen Z + Anzahl der Neutronen N → A = Z + N)
Beispiel: Uran
Ein Uranatom besitzt also 92 Protonen im Kern (und somit auch 92 Elektronen in der Atomhülle).
Aus der Massenzahl lässt sich die Anzahl der Neutronen im Kern bestimmen, da die Massenzahl gleichzeitig die Zahl der Nukleonen (Protonen und Neutronen) im Kern ist.
Daher gilt: N = A – Z = 238 – 92 = 146.
Die Anzahl der Neutronen im Kern beträgt also N = 146.
Für die Grundbausteine eines Atoms ergibt sich folgende Symbolschreibweise:
| Elektron | Masse vernachlässigbar, einfach negativ geladen | |
| Proton | Massenzahl 1, einfach positiv geladen | |
| Neutron | Massenzahl 1, nicht geladen |
Nuklide und Isotope
Jeder Atomkern hat eine bestimmte Anzahl von Protonen und Neutronen.
Alle Atome eines Elements besitzen die gleiche Anzahl von Protonen (also die gleiche Kernladungs- oder Ordnungszahl), können aber eine unterschiedliche Anzahl von Neutronen (und damit verschiedene Massenzahlen) haben.
Ein durch Massenzahl und Kernladungszahl eindeutig charakterisierter Atomkern wird als Nuklid bezeichnet.
Atomkerne mit gleicher Protonenzahl aber unterschiedlicher Anzahl von Neutronen nennt man Isotope.
Beispiel:
Uran (s.o.) kommt in der Natur sowohl mit der Massenzahl 238 (Uran-238) als auch (seltener) mit der Massenzahl 235 (Uran-235) vor. Die beiden Isotope haben die gleiche Anzahl von Protonen aber unterschiedliche Neutronenzahlen.
Da die Kernladungszahl durch das chemische Element festgelegt ist, wird diese in der Symbolschreibweise häufig weggelassen. Mit der Angabe des Elements und der Massenzahl ist ein Nuklid eindeutig charakterisiert.
Im Fließtext wird meist die oben benutzte Schreibweise gewählt, in der die Massenzahl hinter dem chemischen Symbol bzw. dem Element steht (Uran 238, Uran-238 oder U-238).
Info:
Die Massenzahl 1 entspricht in etwa der atomaren Masseneinheit u. Diese ist definiert als 1/12 der Masse des Kohlenstoffisotops C-12. Ein Mol dieses Kohlenstoffisotops hat exakt die Masse 12g.
Die Massenzahl entspricht also in etwa der Atommasse in u (exakt gilt dies nur für das Kohlenstoffisotop C-12).
Eine ausführliche Erklärung der Zusammenhänge zwischen Atommasse, Stoffmenge, Teilchenzahl etc. findest Du im Themenbereich Thermodynamik im Abschnitt zur universellen Gasgleichung.
Der α-Zerfall
Beim α-Zerfall werden sogenannte α-Teilchen (das sind doppelt positiv geladene Heliumkerne – Symbolschreibweise: ![]() ) aus dem Atom mit hoher kinetischer Energie ausgesandt.
) aus dem Atom mit hoher kinetischer Energie ausgesandt.
Beispiel:
Der Kern des Radiumisotops Ra-224 ist nicht stabil, da die Kernkräfte die abstoßenden Kräfte der Protonen untereinander nicht vollständig aufheben können. Der Kern hat deshalb das Bestreben, in einen stabileren Zustand überzugehen. Das geschieht in mehreren Stufen. Man spricht von einer sog. Zerfallsreihe, die aus den Kernreaktionsgleichungen der einzelnen Stufen zusammengesetzt ist:
Zerfallsreihe für Ra 224:
![]()
Mit Berücksichtigung der Aussendung von α-Teilchen:
![]()
Es entsteht jeweils ein neues Element, wobei die Kernladungszahl um 2, die Massenzahl um 4 sinkt. Für den α-Zerfall gilt also:
Kernumwandlung: ![]()
Der β-Zerfall
Beim β-Zerfall werden β-Teilchen vom Kern emittiert. Dabei handelt es sich um Elektronen oder Positronen.
Man unterscheidet zwischen β–-Zerfall und β+-Zerfall.
a) β–-Zerfall
Beim β–-Zerfall wandelt sich ein Neutron im Kern in ein Proton und ein Elektron um.
Reaktionsgleichung:
![]()
Beispiel für einen β–-Zerfall:
![]()
bzw. unter Berücksichtigung der Aussendung von Elektronen
![]()
Da der Kern anschließend ein Proton mehr besitzt, erhöht sich die Kernladungszahl um 1, die Massenzahl bleibt gleich.
Kernumwandlung: ![]()
β-Strahlen bilden einen Elektronenstrom, der die gleichen Eigenschaften zeigt wie der elektrische Strom in metallischen Leitern. So erzeugen z.B. beide ein Magnetfeld, dessen Feldlinien in konzentrischen Kreisen zur Ausbreitungsrichtung liegen.
b) β+-Zerfall
Bei natürlichen und künstlich hergestellten Radionukliden kann auch eine Strahlung auftreten, bei der Teilchen mit der Masse eines Elektrons aber mit positiver Ladung herausgeschleudert werden. Es handelt sich um Positronen.
Wenn sich im Kern ein Proton in ein Neutron und in ein Positron umwandelt, entsteht die sog. β+-Strahlung.
Reaktionsgleichung:
![]()
Beispiel für einen β+-Zerfall:
![]()
Die Kernladungszahl nimmt um 1 ab, die Massenzahl bleibt gleich.
Kernumwandlung: ![]()
Es gibt noch ein weiteres Teilchen…
Der Vorgang des Zerfalls eines Kernneutrons in ein Proton und ein Elektron würde alleine drei Erhaltungssätze (Energie-, Impuls- und Drehimpulserhaltungssatz) verletzen, deren Gültigkeit auch im atomaren Bereich allgemein anerkannt wird.
Wolfgang Pauli postulierte 1932 ein weiteres beim Betazerfall beteiligtes Teilchen, so dass alle Erhaltungssätze erfüllt sind. Dieses Teilchen hat eine sehr kleine Ruhemasse (2eV oder weniger) und keine elektrische Ladung. Es wurde Neutrino (kleines Neutron) genannt.
Bei der Umwandlung eines Neutrons in ein Proton und ein Elektron (β–– Zerfall) entsteht ein Antineutrino, bei der Umwandlung eines Protons in ein Neutron und ein Positron (β+– Zerfall) ein Neutrino. Neutrinos und Antineutrinos besitzen ein großes Durchdringungsvermögen und sind deshalb sehr schwer nachzuweisen. Der Nachweis gelang erst 1956, also 24 Jahre später!
Hinweis:
Bei den Kernreaktionsgleichungen wurden hier aus Gründen der Vereinfachung Neutrino und Antineutrino nicht mit angegeben.