Beispielaufgaben zu den Gasgesetzen
Der erste Schritt bei der Lösung von Aufgaben zu den Gasgesetzen ist es zu ermitteln, welche der drei Zustandsgrößen konstant bleibt, also welche Art von Zustandsänderung vorliegt. Daraus ergibt sich dann, welches der Gasgesetze angewandt werden kann.
Aufgabe 1:
Bei einer Temperatur von 18 °C beträgt der Druck in einem Autoreifen 220 kPa.
Das Auto steht auf einem Parkplatz in der Sonne. Dadurch erhöht sich die Temperatur im Reifen auf 55 °C.
Frage: Auf welchen Wert vergrößert sich der Reifendruck?
Vorüberlegung:
Gegeben sind folgende Größen:
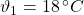
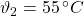
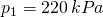
Gesucht ist 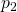
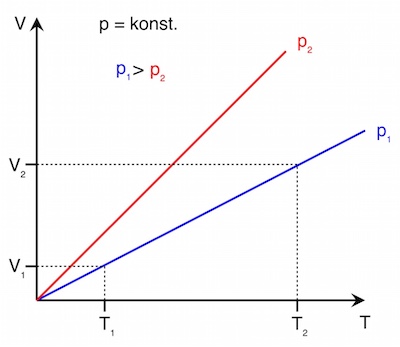
In diesem Beispiel ändern sich Temperatur T und Druck p. Das Volumen V eines Autoreifens ist jedoch unabhängig vom Druck weitgehend konstant.
Es gilt also V = konst.
Damit handelt es sich annähernd um eine isochore Zustandsänderung, und es lässt sich das Gesetz von Amontons anwenden:
Es gilt also:
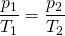
Gesucht ist in diesem Beispiel p2 (s.o.). Umstellen der Gleichung nach p2 ergibt:
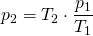
Nun werden die Werte eingesetzt.
Wichtig dabei ist, dass man alle Werte in den Basiseinheiten einsetzt, also
Temperaturen in Kelvin: T1 = 291,15 K, T2 = 328,15 K
Druck in Pascal: p1 = 220.000 Pa
Damit ergibt sich:
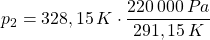
Das Ergebnis lautet:
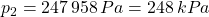 (Das sind
(Das sind 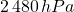 oder
oder 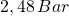 )
)
Aufgabe 2:
Wie viel Luft entweicht aus einem quaderförmigen Raum mit 10 m Länge, 6 m Breite und 4 m Höhe, wenn die Raumtemperatur von 12 °C auf 20 °C erhöht wird und der Luftdruck konstant bleibt?
Vorüberlegung:
Gegeben sind folgende Größen:
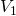 → kann aus den Abmessungen des Raumes berechnet werden:
→ kann aus den Abmessungen des Raumes berechnet werden:
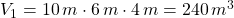
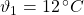
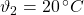
Gesucht ist die Volumenänderung ΔV = V2 – V1. Da V1 bekannt ist (s.o.), muss also zunächst V2 berechnet werden.
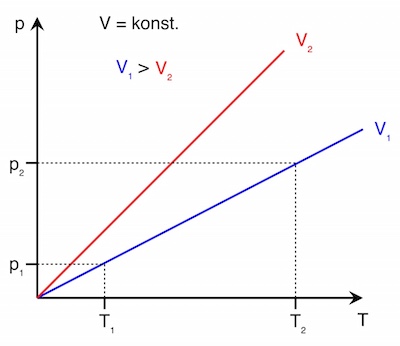
Da der Luftdruck konstant bleibt (p = konst.), handelt es sich um eine isobare Zustandsänderung.
Damit lässt sich das Gesetz von Gay-Lussac anwenden:
Es gilt:
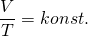
bzw.
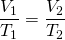
Nun stellen wir diese Gleichung nach V2 um
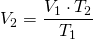
und setzen die Werte ein (alle Werte in Basiseinheiten umrechnen!):
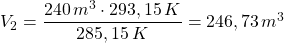
Nun muss noch die Volumenänderung berechnet werden:
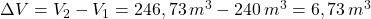
Antwort: Es entweichen 6,73 m3 Luft aus dem Raum.
Aufgabe 3:
Wie viel Luft entweicht aus dem Raum der vorherigen Aufgabe, wenn gleichzeitig der Luftdruck von 1020 mbar auf 981 mbar sinkt?
Vorüberlegung:
Zusätzlich zu den in Aufgabe 2 genannten Größen gilt:
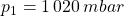
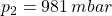
Da sich nun alle drei Zustandsgrößen ändern, liegt kein Spezialfall vor. Es reicht also nicht aus, nur eines der Gasgesetze anzuwenden.
Da der Druck kleiner wird, ist zu erwarten, dass mehr Luft entweichen wird als in Aufgabe 2.
Da sich alle Zustandsgrößen ändern, kann man die Allgemeine Gasgleichung benutzen. Diese lautet:
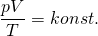 bzw.
bzw. 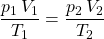
Gesucht ist wieder die Volumenänderung, also zunächst V2.
Die allgemeine Gasgleichung muss also nach V2 umgestellt werden:
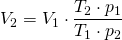
Nun werden die Werte eingesetzt (Basiseinheiten!*):
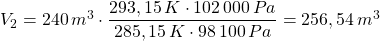
* Hinweis:
In diesem Fall hätte man die Einheit des Drucks auch bei mbar belassen können, da sich die Einheit wegkürzt und das Verhältnis 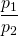 unabhängig von der Einheit ist. Das gilt jedoch nicht für die Temperatur! Hier muss immer die absolute Temperatur eingesetzt werden.
unabhängig von der Einheit ist. Das gilt jedoch nicht für die Temperatur! Hier muss immer die absolute Temperatur eingesetzt werden.
Nun muss noch die Volumenänderung berechnet werden:
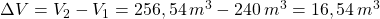
Antwort: In diesem Fall entweichen 16,54 m3 Luft aus dem Raum.
Wie erwartet ist die entweichende Luftmenge größer als beim konstantem Druck in Aufgabe 2.
Alternative Lösung ohne Allgemeine Gasgleichung
Eine alternative Lösung ohne die allgemeine Gasgleichung anzuwenden ist möglich, wenn man sich überlegt, dass es keine Rolle spielt, ob sich Temperatur und Druck gleichzeitig oder nacheinander ändern.
Da wir in Aufgabe 2 bereits die Volumenänderung durch die Temperaturerhöhung berechnet haben, lässt sich in einem zweiten Schritt die Volumenänderung durch die Druckverminderung bei der konstanten Temperatur von 20 °C berechnen:
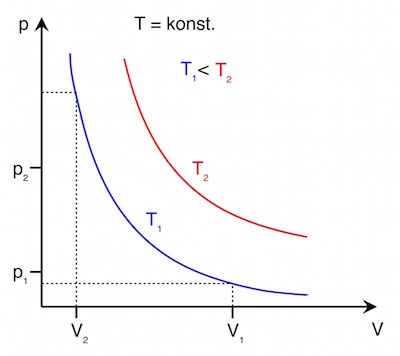
Nimmt man also an, dass die Temperaturerhöhung bereits abgeschlossen ist und sich nun anschließend der Druck ändert, liegt eine isotherme Zustandsänderung vor, und es lässt sich das Gesetz von Boyle-Mariotte anwenden:
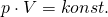 bzw.
bzw. 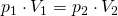
Umgestellt nach V2 ergibt sich:
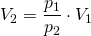
Einsetzen der Werte liefert
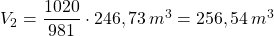
(Die Einheiten beim Druck kürzen sich weg, für V1 muss hier das Volumen nach der Temperaturänderung eingesetzt werden.)
Wir erhalten also auch auf diese Weise das gleiche Ergebnis für V2 wie mit der allgemeinen Gasgleichung!