Wie sind Atome aufgebaut?
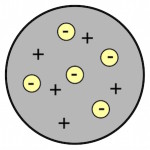
Eine erste Idee zum Aufbau von Atomen lieferte Joseph John Thomson (1856-1940), der als Entdecker des Elektrons gilt. Er erkannte, dass in einem Atom sowohl Elektronen als auch positive Ladungen enthalten sind, und stellte sich ein Atom wie einen Rosinenkuchen vor, bei dem das Atom selbst aus einer homogenen, positiv geladenen Masse besteht, in denen Elektronen wie Rosinen in einem Kuchen eingebettet sind:
Thomson’sches Atommodell
Ernest Rutherford führte im Jahre 1911 ein später nach ihm benanntes Experiment durch, mit dem er die Atomvorstellung von Thomson widerlegte.
Das Rutherford-Experiment (1909)
In diesem Experiment ließ Rutherford einen Strahl von α-Teilchen (dabei handelt es sich um Helium-Kerne, bestehend aus 2 Protonen und 2 Neutronen)) auf eine dünne Goldfolie (einige hundert Atomlagen) treffen.
Dabei stellte er fest, dass die meisten α-Teilchen die Goldfolie ungehindert durchdringen. Nur wenige werden abgelenkt oder reflektiert.
Damit war klar:
Atome sind zu einem sehr großen Teil leer. Es muss allerdings ein sehr kleines Objekt im Atom existieren, dass praktisch die gesamte Masse des Atoms in sich vereint.
Aus der Berechnung der Streuung der α-Teilchen folgt, dass das streuende Objekt positiv geladen sein muss. Man bezeichnet es als Atomkern.
Der Atomkern ist um etwa den Faktor 100.000 kleiner als der Atomradius.
Ein Beispiel aus unserer Lebenswelt verdeutlicht dieses Verhältnis:
Wäre ein Atom so groß wie ein Fußballstadion, so wäre der Atomkern so klein wie ein Reiskorn auf dem Mittelkreis.
Aus den Erkenntnissen des Rutherford-Experiments folgte 1911 ein weiteres Atommodell.
In diesem Modell besteht das Atom aus einem kleinen positiv geladenen Kern, der von Elektronen umgeben wird. Die Anzahl der Elektronen entspricht der Anzahl an positiven Ladungen im Kern (Kernladungszahl). Das erklärt die elektrische Neutralität von Atomen.
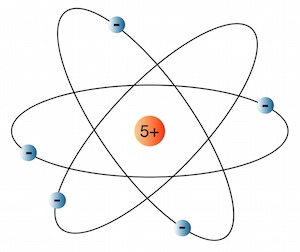
Häufig wird in Zusammenhang mit Rutherford das sogenannte Planetenmodell erwähnt, welches jedoch nicht direkt von Rutherford stammt:
In diesem Modell kreisen die Elektronen um den Kern wie Planeten um die Sonne.
Das Problem an diesem Modell ist aber, dass nach den Gesetzen der Elektrodynamik beschleunigte Elektronen ständig Energie abgeben müssten, was dazu führen würde, dass sie nach kurzer Zeit in den Kern stürzen würden.
Genauere Erkenntnisse über den Aufbau von Atomen lieferten die Untersuchungen der Linienspektren von Gasen.