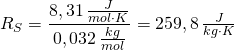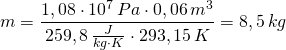Von der allgemeinen Gasgleichung zur universellen Gasgleichung
Die Allgemeine Gasgleichung lautet: ![]()
Dabei ist der Wert für die Konstante auf der rechten Seite nicht beziffert.
Doch wovon hängt diese Konstante ab?
Vorüberlegung:
Bei gleichem Druck und gleicher Temperatur ist das Volumen eines Stoffs umso größer, je größer die Stoffmenge bzw. die Anzahl der Teilchen (Atome oder Moleküle) ist.
Offensichtlich gilt:
Die doppelte Gasmenge (also die doppelte Teilchenzahl) nimmt bei gleichen äußeren Bedingungen das doppelte Volumen ein. Das Volumen ist bei gleichem Druck und gleicher Temperatur also proportional zur Teilchenzahl N.
Es muss also gelten:
![]() (mit N = Teilchenzahl)
(mit N = Teilchenzahl)
Um daraus eine Gleichung zu machen, benötigen wir einen Proportionalitätsfaktor, den wir k nennen.
Damit gibt sich:
![]() oder umgeformt
oder umgeformt ![]()
Diese Gleichung wird als thermische Zustandsgleichung idealer Gase oder auch universelle Gasgleichung bezeichnet.
Die Konstante k ist dabei die Boltzmann-Konstante. Man erhält sie, wenn die Zustandsgrößen und die Teilchenzahl eines Gases bekannt sind und man diese Werte in die nach k umgestellte Gleichung einsetzt:
![]()
Die Einheit der Boltzmann-Konstanten ergibt sich aus den Einheiten der verknüpften Größen:
![]()
(Es gilt: ![]() und
und ![]() )
)
Der Literaturwert der Boltzmann-Konstanten beträgt
![]()
Wie man die Boltzmann-Konstante aus bekannten Zusammenhängen berechnen kann, erfährst Du weiter unten.