Erhöhung der Temperatur durch Zufuhr von Energie
Die Temperatur eines Körpers lässt sich durch die Zufuhr von Wärme erhöhen, aber auch durch Zufuhr mechanischer Arbeit W (z.B. durch Reibung beim bremsen, bohren, sägen etc.).
Die Zufuhr von Wärme kann jedoch außer einer Temperaturerhöhung weitere Auswirkungen haben:
- Änderung des Volumens bzw. der Länge eines Körpers (Ausdehnung bei Erwärmung)
- Änderung des Drucks
- Änderung des Aggregatzustandes
Innere Energie
Die gesamte im Inneren eines Körpers gespeicherte Energie wird als innere Energie U bezeichnet.
Aufgrund der Anziehungskräfte zwischen den Teilchen im festen und flüssigen Zustand wird Energie benötigt, um einen festen Stoff zum schmelzen oder eine Flüssigkeit zum verdampfen zu bringen. Die dafür zugeführte Energie wird als potentielle Energie der Teilchen gespeichert.
Eine weitere Energiezufuhr führt zur Erhöhung der Temperatur, also zur Erhöhung der mittleren kinetischen Energie.
Die Summe aus potentieller und kinetischer Energie wird zusammenfassend als thermische Energie bezeichnet.
Daneben steckt zusätzlich chemische Energie und nukleare Energie in einem System.
Da sich bei thermischen Prozessen chemische und nukleare Energie nicht verändern, werden diese in der Wärmelehre bei der Betrachtung der inneren Energie nicht berücksichtigt.
Die Änderung der inneren Energie ist in der Thermodynamik daher gleichbedeutend mit einer Änderung der thermischen Energie.
| Innere Energie |
kinetische Energie |
Thermische Energie |
| potentielle Energie |
| chemische Energie |
spielt bei thermodynamischen Prozessen keine Rolle |
| nukleare Energie |
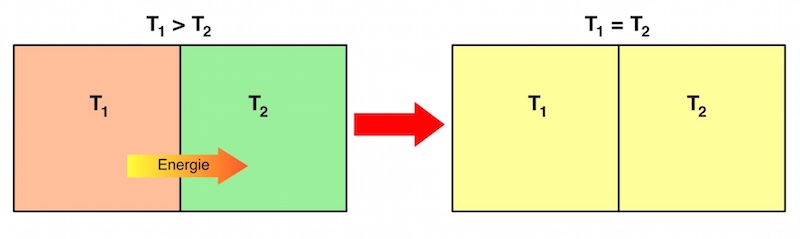
Nimmt ein Körper Wärme auf, so vergrößert sich seine thermische Energie. Gibt er Wärme ab, so verringert sich seine thermische Energie.
Die Wärme oder Wärmemenge gibt an, wie viel thermische Energie von einem Stoff bzw. Körper auf einen anderen übertragen wird.
Änderung der inneren Energie im Teilchenmodell
Die Änderung der inneren bzw. thermischen Energie eines Stoffs kann mit dem Teilchenmodell beschrieben werden:
Alle Körper bestehen aus kleinsten Teilchen (Atome bzw. Moleküle). Diese befinden sich bei allen Temperaturen oberhalb des absoluten Nullpunktes in ständiger Bewegung (→ Brown’sche Bewegung).
Je schneller die Bewegung ist (genauer: je größer die mittlere Geschwindigkeit der Teilchen ist → s. kinetische Gastheorie), umso höher ist die Temperatur des Körpers.
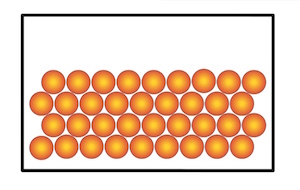
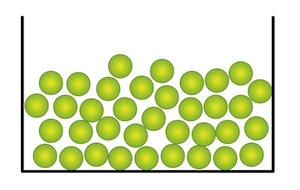
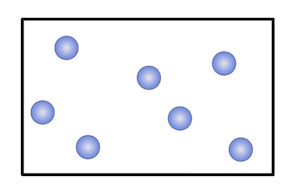
Je nach Aggregatzustand gibt es verschiedene Möglichkeiten der Teilchenbewegung:
Die Teilchendichte ist im festen und flüssigen Zustand etwa gleich – im gasförmigen Zustand ist sie jedoch wesentlich kleiner.
Mit dem Teilchenmodell lässt sich die Wärmeübertragung (s.o.) folgendermaßen erklären:
Die schnelleren Teilchen des heißeren Körpers stoßen mit den langsameren Teilchen des kälteren Körpers zusammen und übertragen einen Teil ihrer Energie auf diese.
Die mittlere kinetische Energie der Teilchen und damit die innere Energie des heißen Körpers nimmt dabei ab, die innere Energie des kälteren Körpers nimmt zu.