Messung der Wärmeenergie
Die einem Körper oder einem Stoff zugeführte Wärmeenergie Q soll nun qualitativ erfasst werden.
Führt man einem Körper Energie in Form von Wärme zu, ohne dass sich sein Aggregatzustand ändert, so erhöht sich seine Temperatur.
Frage:
Wie kann man aus der Temperaturänderung eines Körpers auf die zugeführte Wärme schließen?
Die Energie, die man braucht, um einen Körper bzw. einen Stoff zu erwärmen, hängt ab
- von der Temperaturerhöhung
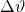
- von der Stoffmenge
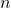 bzw. der Masse
bzw. der Masse 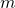 des erwärmten Stoffs
des erwärmten Stoffs - von der Art des Stoffs (Material)
Bestimmung der benötigten Energie zur Erwärmung von Wasser
Die Abgabe einer definierten Energiemenge an einen Stoff ermöglicht ein Tauchsieder in Wasser. Die vom Tauchsieder abgegebene Energie wird vom Wasser praktisch vollständig aufgenommen.
Vorüberlegungen:
1) Wie ermittelt man die vom Tauchsieder abgegebene Energie E?
Auf dem verwendeten Tauchsieder findet man die Angabe der Leistung P. Sie beträgt in unserem Fall P = 300 W (Watt).
Das bedeutet, der Tauchsieder gibt pro Sekunde eine Energie von E = 300 J (Joule) an das Wasser ab, denn es gilt:
![]() bzw.
bzw. ![]() und damit
und damit ![]()
und damit für die Einheiten
![]() bzw.
bzw. ![]()
Die vom Wasser aufgenommene Wärme Q entspricht der vom Tauchsieder abgegebenen Energie E.
Um diese zu ermitteln, braucht man also nur die Zeitspanne ![]() der Erwärmung zu messen.
der Erwärmung zu messen.
2) Zusammenhang zwischen aufgenommener Wärme Q und Wassermenge
Erwärmt man verschiedene Wassermengen mit dem gleichen Tauchsieder, so dauert es umso länger, eine bestimmte Temperaturerhöhung ![]() bzw.
bzw. ![]() zu erreichen, je größer die Wassermenge ist.
zu erreichen, je größer die Wassermenge ist.
Für die doppelte Wassermenge wird die doppelte Zeit und damit die doppelte Energie benötigt.
(Gedankenexperiment: Erhitzt man nacheinander zweimal die gleiche Wassermenge um den gleichen Temperaturbetrag, so wird dies jeweils gleich lange dauern. Insgesamt benötigt man also die doppelte Zeit und damit die doppelte Energie.)
Es gilt also:
Die benötigte Energie E und damit die ausgetauschte Wärme Q ist proportional zur Masse m des erwärmten Wassers:
![]()
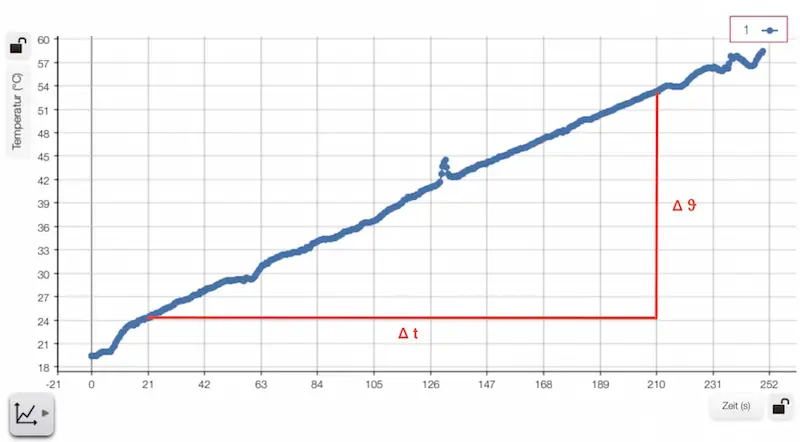
Außerdem dauert die Erwärmung natürlich umso länger, je größer die Temperaturdifferenz ![]() ist, also je heißer das Wasser werden soll.
ist, also je heißer das Wasser werden soll.
Der Zusammenhang zwischen Temperaturdifferenz und benötigter Wärme soll mit dem nachfolgenden Versuch ermittelt werden: