Der lineare Potentialtopf
Das Modell des linearen Potentialtopfes zur Beschreibung des Aufenthalts eines Elektrons scheint zunächst ein wenig abstrakt zu sein und wirft vielleicht die Frage auf, was das alles mit einem Atom zu tun haben soll. Die Bezeichnung “linearer Potentialtopf” ergibt sich letztendlich aus einer bestimmten Darstellung der potentiellen Energie, die an einen Topf erinnert.
Beschreibung des Aufenthalts eines Elektrons in einem begrenzten Bereich
Beim Modell des linearen Potentialtopfes geht es zunächst darum, einen möglichst einfachen Fall des Verhaltens eines Teilchens (z.B. eines Elektrons) zu betrachten und das Prinzip zu verstehen. Die Übertrageung auf ein Atom erfolgt zu einem späteren Zeitpunkt. Insofern ist der lineare Potentialtopf der erste Schritt zum quantenmechanischen Atommodell.
Grundüberlegung:
Die Überlegung, die zu diesem Modell führt, ist folgende:
Der Aufenthalt eines Elektrons, welches sich in einem bestimmten Bereich aufhalten kann, also quasi in diesem Bereich “eingesperrt” ist, kann durch eine stehende Welle beschrieben werden. Das Quadrat der Amplitude kann dabei als Wahrscheinlichkeit, das Elektron an einem bestimmten Ort anzutreffen, angesehen werden.
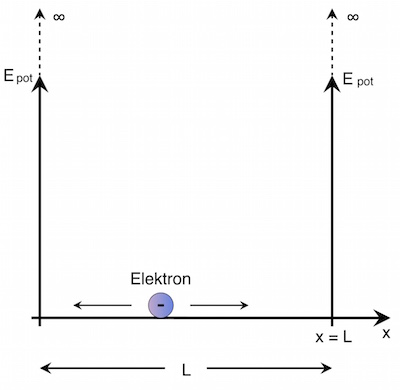
Anstelle eines (dreidimensionalen) Atoms stellt man sich nun einen eindimensionalen Bereich (also eine bestimmte Länge L) vor, in dem sich das Elektron aufhalten kann. Es soll sich in diesem Bereich kräftefrei bewegen können (wobei “bewegen” eigentlich das falsche Wort ist). Das bedeutet, es gibt keine weitere Ladung in diesem Bereich – also auch keinen Atomkern.
Wenn sich das Elektron kräftefrei “bewegen” kann, bedeutet dass, dass die potentielle Energie in diesem Bereich Null ist (![]() ). Da es sich aber außerhalb dieses Bereiches nicht aufhalten kann, muss die potentielle Energie außerhalb dieses Bereichs unendlich groß sein.
). Da es sich aber außerhalb dieses Bereiches nicht aufhalten kann, muss die potentielle Energie außerhalb dieses Bereichs unendlich groß sein.
Analogie:
Eine Kugel befindet sich in einem Topf und kann zwischen den Wänden des Topfes hin und her rollen. Damit die Kugel den Topf nicht verlassen kann, egal wie viel kinetische Energie sie besitzt, müssten die Wände des Topfes unendlich hoch sein.
Zusammenfassung:
Beim Modell des linearen Potentialtopes geht man von folgenden Vereinfachungen gegenüber einem Atom aus:
- Ein Elektron ist in einem bestimmten eindimensionalen Bereich der Länge L eingesperrt.
- Innerhalb dieses Bereichs ist die potentielle Energie Epot = 0, außerhalb dieses Bereichs wird Epot unendlich.
Damit ist die Aufenthaltswahrscheinlichkeit des Elektrons innerhalb des Bereichs 1, außerhalb dieses Bereichs ist sie 0.
Wenn Epot innerhalb des Bereichs Null ist, kann sich das Elektron innerhalb der Länge L kräftefrei “bewegen”.
Auch wenn ein Atom natürlich dreidimensional ist und es im Atom durch den positiv geladenen Atomkern sehr wohl ein Potential gibt, lässt sich mit diesem Modell gut veranschaulichen, dass allein durch die Tatsache, dass der Aufenthaltsbereich eines Teilchens auf einen bestimmten Bereich eingeschränkt ist und der Aufenthalt des Teilchens mit einer Wellenfunktion beschrieben wird, es nur diskrete mögliche Energien gibt.
Trägt man die potentielle Energie ![]() und den Weg
und den Weg ![]() gegeneinander auf, so erhält man eine Funktion mit der Form eines Topfes mit unendlich hohen Wänden:
gegeneinander auf, so erhält man eine Funktion mit der Form eines Topfes mit unendlich hohen Wänden:
Aus der Form der Darstellung der potentiellen Energie stammt die Bezeichnung “Potentialtopf” (s. Analogie oben).
Wellenfunktionen und Wahrscheinlichkeitenen
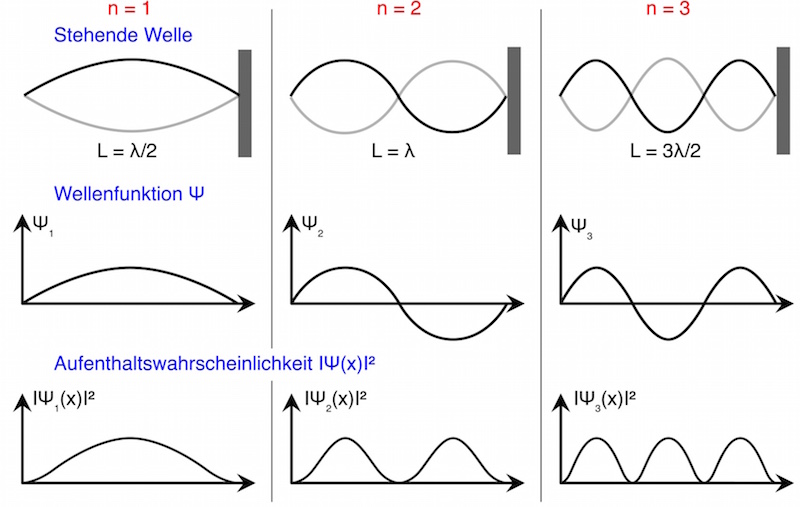
Die Wellenfunktion ![]() , die den Aufenthalt des Elektrons beschreibt (s.o.), kann wie die einer eingespannten Feder nur bestimmte Schwingungsformen annehmen:
, die den Aufenthalt des Elektrons beschreibt (s.o.), kann wie die einer eingespannten Feder nur bestimmte Schwingungsformen annehmen:
Die stehende Welle der eingespannten Feder entspricht bei dieser Analogie einer Wellenfunktion ![]() . Das Quadrat ihres Betrages
. Das Quadrat ihres Betrages ![]() gibt die Wahrscheinlichkeitsdichte an, das Elektron am Ort x aufzufinden.
gibt die Wahrscheinlichkeitsdichte an, das Elektron am Ort x aufzufinden.
Das Produkt ![]() gibt die Wahrscheinlichkeit dafür an, dass sich das Elektron im Raumbereich (bzw. hier eindimensional)
gibt die Wahrscheinlichkeit dafür an, dass sich das Elektron im Raumbereich (bzw. hier eindimensional) ![]() befindet.
befindet.
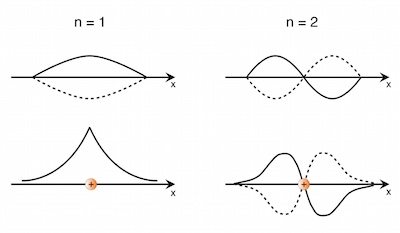
Für den Grundzustand (n = 1) erkennt man:
Die Wahrscheinlichkeitsdichte ist in der Mitte der Länge L (also bei x = L/2) am größten.
Da sich Knoten und Bäuche bei einer stehenden Welle immer am gleichen Ort befinden und sich somit der Betrag der Wellenfunktion zeitlich nicht ändert, ist die Wahrscheinlichkeitsverteilung von der Zeit unabhängig. Man spricht auch von einem stationären Zustand.